Alkohole
Ja, es geht auch um den trinkbaren, mit dem man feiern kann. Aber nicht nur. Die Gruppe der Alkohole ist eine sehr große. Sie heißen auch Alkanole.

Dieses Molekül kennst Du schon. Das ist Methan.
Seine Eigenschaften sind:
- Es ist gasförmig.
- Es ist geruchlos.
- Es ist nicht in Wasser löslich.
- Es reagiert nur ungern mit anderen Stoffen.
- Es ist farblos.
- Es ist brennbar.
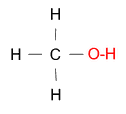
Dieses Molekül ist ähnlich, aber nicht identisch. Das ist Methanol.
Seine Eigenschaften sind:
- Es ist flüssig.
- Es riecht nach Alkohol.
- Es ist gut in Wasser löslich.
- Es reagiert eher als Methan
- Es ist farblos.
- Es ist brennbar.
Vergleicht man diese beiden Stoffe, sieht man Gemeinsamkeiten und Unterschiede in den Eigenschaften, aber auch in den Molekülen:
Statt 4 H's hat Methanol nur 3 H's und eine OH-Gruppe, also de facto ein Sauerstoff mehr.
Und genau das ändert nun alles.
Aufgrund der hohen Anziehungskraft, die Sauerstoff immer auf fremde Elektronen (Elektronegativität genannt) hat, zieht es die Elektronen seiner Bindungsnachbarn zu sich und polarisiert die Gegend, in der es sich befindet. Aus einem unpolaren Stoff, der sich nicht in Wasser löst, wird ein sehr gut in Wasser löslicher, polarer Stoff. Außerdem bildet Methanol - auch wieder wegen des Sauerstoffs - nun Wasserstoffbrücken zu seinen Nachbarmolekülen aus. Die Wasserstoffbrücken sind vielleicht nicht die stärksten des Universums, aber es sind viele und sie reichen aus, damit sich die Moleküle anziehen. Sie sind dann dichter beieinander und brauchen mehr Energie als Methanmoleküle, um sich voneinander zu entfernen und so in den gasförmigen Zustand zu wechseln.
Da diese eine Gruppe, die OH-Gruppe, die Eigenschaften des Moleküls gegenüber dem "Basismolekül" Methan ändert, bezeichnet man sie auch als funktionelle Gruppe. Weitere funktionelle Gruppen sind zum Beispiel die Aldehydgruppe oder die Säuregruppe. Auch sie ändern die Eigenschaften des Basismoleküls, aber auf andere Weise als die OH-Gruppe.
Im Namen werden Alkohole mit der Endung -ol gekennzeichnet. So wird aus einer organischen Verbindung mit einem C-Atom und einer OH-Gruppe ein Methanol. Hat die Verbindung 2 C-Atome, wird daraus Ethanol, mit 3 C-Atomen Propanol usw.
Homologe Reihe der Alkanole
Die homologe Reihe der Alkanole entspricht genau der homologen Reihe der Alkane, nur dass du bei jedem Molekül am Ende ein OH schreibst statt H, so wie im Methanol oben.
Wofür brauchen wir Alkohole?
Die Verwendungsmöglichkeiten sind für jeden Alkohol unterschiedlich. Wir können auf jeden Fall nicht alle davon trinken. Eigentlich meinen wir im Alltag, wenn wir von Alkohol sprechen, den Trinkalkohol Ethanol. Methanol hingegen dürfen wir NICHT trinken: Wir würden erst erblinden und dann sterben.
Die chemische Bezeichnung Alkohol (eigentlich Alkanol) meint also nicht das gleiche wie das umgangssprachliche Wort! Da die Gruppe so riesig ist, schauen wir uns hier nur die ersten 4 Vertreter an:
Methanol brauchen wir aber trotzdem: als Ausgangsstoff für die chemische Industrie, um z.B. Formaldehyd oder Essigsäure herzustellen, als Zusatz zum Treibstoff für Autos oder in der Kunststoffindustrie.
Ethanol können wir trinken, zum Desinfizieren in der Medizin benutzen, Dinge schneller brennen lassen (Brennspiritus), dem Kraftstoff zusetzen (E 10), Thermometer damit füllen, in Kosmetika als Konservierungsmittel einsetzen oder gute Wirkstoffe aus Pflanzen damit lösen, die sich mit Wasser nicht lösen lassen wollen (z.B. für Hustensaft).
Propanol ist für uns ebenfalls nicht giftig. Wir nutzen es daher in Kosmetika, zur Herstellung von Arzneimitteln oder als Ausgangsstoff für Farben.
Butanol wird als Lösungsmittel eingesetzt und dient als Ausgangsstoff für Arzneimittel und Weichmacher sowie als Lösungsmittel in Lacken.
Herstellung von Trinkalkohol
Trinkalkohol (Ethanol) darf nur durch natürliche Vergärungsprozesse gewonnen werden. Der Organismus, der so freundlich ist, dies für uns zu tun, ist die Bäckerhefe.
Sie ist ein Pilz mit der Fähigkeit aus der Atmung (wie wir) oder durch die Umsetzung von Zucker in Ethanol (= Alkoholische Gärung) zu gewinnen.
Diese Fähigkeit nutzt der Mensch schon seit Jahrtausenden (allerdings ohne die meiste Zeit auch nur zu ahnen, wie das funktioniert. Da sind wir heute etwas klüger).
Ich zeige Dir, wie das geht am Beispiel der Weinherstellung. Anstelle von Weintrauben können alle Fruchtsorten verwendet werden, die Glucose enthalten. Beliebt sind hierzulande z.B. Äpfel oder andere Obstsorten.

Dafür brauchen wir zuerst mal Weintrauben. Sie werden geerntet, das nennt man Weinlese.

Dann werden die Trauben zerdrückt. Dieser Vorgang heißt Keltern. Das Wort kommt vom lateinischen calcatorium, was soviel wie Fußtretung bedeutet.
Man erhält einen Brei. Der heißt Maische.
In den meisten Winzereien werden dafür heute Maschinen eingesetzt.
Früher (und auch heute noch in einigen Orten Italiens und Frankreichs) wurden die Trauben aber mit den Füßen zerstampft (daher der Name). Das ist Tradition und gehört zum sozialen Leben.
Dazu gibt es eine berühmte Filmszene mit Adriano Celentano - den Ausschnitt mit dem Stampfen des Weins siehst Du unten, der dauert knapp 3min. Es wird nicht gesprochen, das Stückchen Film ist nur mit Musik unterlegt.


Die Maische wird nun gefiltert - Schalen und Fruchtfleisch werden vom Saft getrennt. Das Produkt der Filterung heißt nun Most.
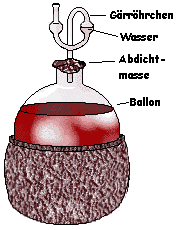
Anschließend wird der Most in einem Gärbehälter vergoren. Das nennt man dann alkoholische Gärung.
Im Hausgebrauch sieht das aus wie auf dem Bild hier: Der Most wird in einen Ballon mit Gärröhrchen gefüllt, in dem Wasser ist.
Im Most befindet sich Hefe, meist wird noch Gärhefe zugesetzt. Diese Hefe kann etwas, was wir nicht können: auch ohne Sauerstoff überleben. Dafür benötigt sie Wasser und Traubenzucker (= Glucose). Beides findet sie im Most. Sie gewinnt ihr ATP, indem sie die Glucose in Ethanol umwandelt. Dafür muss man aber sicherstellen, dass kein Sauerstoff hineingelangt (sonst atmet die Hefe genau wie wir, stellt aber keinen Alkohol her). Das Gärröhrchen ist mit Wasser gefüllt und lässt durch diese Wasserschranke keinen Luftsauerstoff eindringen.
Die Hefe stellt außer Ethanol noch CO2 als Abfallprodukt her. CO2 ist ein Gas und blubbert durch das Wasser. Man kann sehen, wann die Gärung abgeschlossen ist: Da blubbert kein Gas mehr raus. Das ist meist nach einigen Wochen der Fall.
Wortgleichung der alkoholischen Gärung:
Gleichung mit Summenformeln:
Der Gärprozess ist abgeschlossen, wenn:
- der gesamte Zucker verbraucht ist
Dann kann die Hefe nichts mehr essen und stirbt ab. - die maximale Alkoholmenge von 15% erreicht ist
Mehr als 17% verträgt die Hefe nicht - sie stirbt an Alkoholvergiftung.

Ist der Gärprozess fertig, werden Zucker- und Alkoholgehalt bestimmt und der Wein in Flaschen abgefüllt. Viele Weinsorten müssen dann eine zeitlang lagern.

Nach der entsprechenden Lagerzeit kann der Wein getrunken werden.
Die Szene, die Du hier im Bild siehst, stammt aus dem berühmten Film "Die Feuerzangenbowle". Gerade hat die Klasse einen hausgemachten Wein des Chemielehrers verkostet.
Und spielt verrückt ;-) Ich empfehle Dir, diesen Film an einem regnerischen Tag anzusehen. Allerdings ohne Alkohol, besser Tee oder Kaffee mit ein paar Keksen.
Als Trinkalkohol darf nur solcher Alkohol verkauft werden, der durch diesen natürlichen Gärprozess hergestellt wurde.
Chemisch kann Ethanol ebenfalls erzeugt werden, der darf dann aber nicht getrunken werden, sondern dient als Ausgangsstoff für die Herstellung von Duftstoffen, Farben und Lacken, als Lösungsmittel oder zur Desinfektion und für viele andere Dinge.
Destillation
Wein kann maximal 15% Alkoholgehalt erreichen. Es gibt aber viele Schnapssorten, die einen wesentlich höheren Alkoholgehalt haben.
Meist liegt der für Liköre bei ca. 25%, Whiskey hat meist 35-40%, Obstbrand sogar um die 70%. Wie kann nun also der Gehalt an Alkohol erhöht werden? Indem man das Wasser vom Ethanol im Wein trennt. Will ein Chemiker zwei Stoffe voneinander trennen, schaut er auf die Eigenschaften dieser Stoffe und sucht nach Unterschieden, durch die man sie trennen kann.
Wasser siedet bei 100°C, Ethanol schon bei 78°C. Diesen Unterschied kann man leicht bei einer Destillation nutzen: Man erwärmt den Wein auf 80-85°C. Das Ethanol siedet dann schon und steigt als Dampf auf, das Wasser siedet noch nicht und bleibt zurück. Nun muss man den Alkoholdampf nur vom Wasser wegleiten und in einem anderen Gefäß kondensieren lassen. Dann ist viel weniger Wasser im Alkohol. Meist werden bei dieser Prozedur viele Wassermoleküle mitgerissen und die Erhöhung des Alkoholanteils ist zwar deutlich, aber nicht vollständig.
Hier siehst Du die Destillation in einem kleinen Video (Untertitel gibt es):

Im Video hast Du gesehen, wie die Destillation funktioniert und wie man anschließend den Alkoholgehalt über die Dichte bestimmen kann. Ethanol ist nämlich leichter als Wasser.
Die 10 ml, die er hier gewogen hat, würden bei reinem Wasser genau 10 g wiegen.
Dasselbe Volumen (10 ml) reines Ethanol (100%) wiegt aber nur 7,8 g. Je näher das Gewicht diesen 7,8 g kommt, desto mehr Alkohol hat man im Destillat.
Außerdem zeigt er, dass man Ethanol anzünden kann. Es ist brennbar (Wasser ist nicht brennbar) und brennt mit blauer Flamme. Giftiges Methanol und trinkbares Ethanol lassen sich durch Anzünden voneinander unterscheiden. Auch dafür gibt es ein Video (leider ohne Untertitel, sieht man aber gut):

Ethanol verbrennt also mit bläulicher Flamme, Methanol mit deutlich grüner.
Mehrwertige Alkohole
Die Alkohole der homologen Reihe (Methanol bis Decanol) haben wir nun besprochen. Sie tragen alle eine OH-Gruppe und sind deshalb einwertige Alkohole.
Es gibt aber auch Alkohole mit mehr als einer OH-Gruppe. Das sind die mehrwertigen Alkohole.
Zwei Vertreter musst Du kennen: Glykol und Glycerin. Ich will sie Dir kurz vorstellen.
Glykol

Glykol besitzt zwei OH-Gruppen. Er ist deshalb ein zweiwertiger Alkohol.
Der Name Glykol ist der sogenannte Trivialname (man kann auch sagen der umgangssprachliche Name). Chemiker benennen das Molekül nach der IUPAC-Nomenklatur.
Die Nomenklatur (auch IUPAC-Nomenklatur genannt) ist das Regelwerk, das die Namensgebung bestimmt, sodass alle Chemiker auf der ganzen Welt die Moleküle gleich benennen können. Wir haben sie schon kennengelernt. Z.B. weißt Du, dass Moleküle mit 2 C-Atomen "Eth-" im Namen haben. Wenn sich zwischen den C-Atomen eine Einfachbindung befindet, kommt die Endung "-an" dran. Zusammen ist das dann Ethan. Eine solche Benennung folgt dieser Nomenklatur. Alkohole (also Stoffe mit OH-Gruppe) erhalten die Endung "-ol". Auch das weißt Du bereits. Dann wird aus dem Ethan ein Ethanol. Der Chemiker weiß jetzt, dass es sich um eine Substanz handelt, in deren Molekülen 2 C-Atome mit einer Einfachbindung und einer OH-Gruppe verbunden sind.
Das stimmt so aber noch nicht, weil Glykol nicht nur eine, sondern zwei OH-Gruppen hat. Das muss im Namen ersichtlich sein. Und auch dafür gibt es eine Regel: Vor der Endung -ol, die die Anwesenheit einer OH-Gruppe anzeigt, wird deren Anzahl benannt. Das geschieht mit dem Wörtchen "di", was zwei heißt. Dann wird aus Ethanol das Ethandiol. Jetzt stimmt es schon fast. Man muss noch mitteilen, an welchem C sich die OH-Gruppen befinden. Der genaue Name von Glykol nach IUPAC lautet: Ethan-1,2-diol..

Glykol (oder Ethandiol) ist eine giftige, süßliche Flüssigkeit. Es ist viskos (=dickflüssig, ähnlich wie Öl).
Es wird vor allem als Frostschutzmittel eingesetzt, dient aber auch als Grundstoff zur Herstellung von Wachsen, Lacken, Kunstharzen und Kunststoff (Polyester).
Glycerin

Glycerin (oder Glyzerin) besitzt drei OH-Gruppen. Es ist ein dreiwertiger Alkohol.
Auch Glycerin ist der Trivialname.
Nach Nomenklatur heißt es Propan-1,2,3-triol.
Es ist ebenfalls süß, aber ungiftig. Seine Viskosität ist eher sirupartig. Es ist also viskoser als Glykol.
Glycerin findet man in der Natur vor allem als Bestandteil der Fettmoleküle. Die drei Fettsäuren eines Fettmoleküls sind mit den OH-Gruppen des Glycerins verbunden (eine solche Verbindung ist ein Ester)
Es dient aber auch einigen Insektenarten als natürlicher Frostschutz zur Überwinterung.

Da Glycerin nicht giftig ist, aber sehr gut Feuchtigkeit speichern kann, wird es als Feuchthaltemittel z.B. in Backwaren, Kosmetika, für Tabak, Shishas und Filmrollen verwendet.
Seine Viskosität macht es als Schmierstoff und Weichmacher geeignet. In der Medizin dient es als Arznei zur Behandlung von Hirnödemen und als Zusatz von Abführmitteln.
Außerdem wird es noch, in Verbindung mit einer Nitrogruppe (NO2), als Nitroglycerin in der Sprengstoffindustrie und in der Medizin verwendet.
Nitroglycerin

Die Geschichte des Nobelpreises ist untrennbar mit seinem Namensgeber Alfred Nobel und Nitroglycerin verbunden.
Alfred Nobel war ein schwedischer Chemiker des 19. Jahrhunderts.
Er war ein sehr gut ausgebildeter Mensch. Bereits im Alter von 17 Jahren beherrschte er 5 Sprachen. Er lernte in Paris auf einer Studienreise Sobrero kennen, der Nitroglycerin erfunden hatte, und war davon fasziniert. Nitroglycerin ist aber eine hochexplosive Flüssigkeit. Ihre wertvollen Eigenschaften als Sprengstoff konnten deshalb nicht einfach so genutzt werden. Nobels Verdienst war es, das Nitroglycerin für die Handhabung sicher zu machen. Er füllte es in Kieselgur und erfand damit das Dynamit. Das klingt sehr einfach, war es aber nicht. Seine Experimente, bei denen das Zeug immer wieder explodierte, haben das Labor im Jahr 1864 ausgebrannt und seinen Bruder und 4 weitere Menschen das Leben gekostet! Auch als er es endlich soweit hatte, das es gefahrlos gezündet werden konnte, und die Massenproduktion begann, ereigneten sich immer wieder schwere Unfälle.
Das Militär entdeckte den Sprengstoff für den Krieg und Nobel bekam den Beinamen "Kaufmann des Todes". Das entsetzte ihn und er schuf aus seinem riesigen Vermögen, das er mit seinem Dynamit gemacht hatte, eine Stiftung. Er verfügte in seinem Testament, dass Menschen mit einem Preis und Geld geehrt werden, "die im vergangenen Jahr der Menschheit den größten Nutzen erbracht haben". Der Nobelpreis war geboren. Die Gebiete, auf denen jährlich der Nobelpreis vergeben wird, sind Medizin, Chemie, Physik, Literatur und Frieden.
Rätsel zum Thema - Teste Dich!
Quiz zu den Alkoholen mit Fragen, die in der mündlichen Prüfung schon gestellt wurden



Kommentar schreiben
Larissa (Samstag, 12 September 2020 11:31)
Es wär schon wenn noch eine Übersichtstabelle der Alkanole ergänzt wird.
Lisa (Donnerstag, 25 März 2021 20:58)
...